LEISTUNGSVERZEICHNIS
Version: 1.0 / 03.2024
In dem ausklappbaren Menü unten finden Sie die Übersicht der Leistungen.
Bitte klicken Sie auf das „+“ Zeichen, um die jeweiligen Inhalte zu lesen.
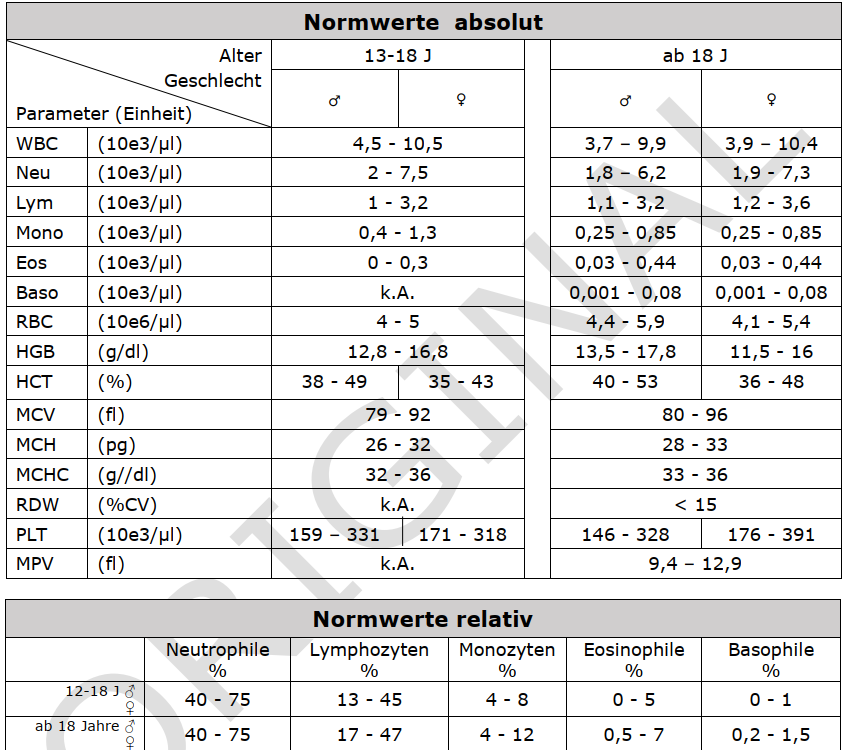
Großes BLUTBILD
LYMPHOZYTEN-DIFFERENZIERUNG (Immunstatus)
HIV (HUMANES IMMUNDEFIZIENZ –VIRUS):
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum oder Plasma |
| Referenzbereich: | negativ |
| Indikation: | Verdacht auf eine HIV Infektion |
| Hinweis: | HIV p24-Antigen in Blutproben kürzlich infizierter Patienten kann bereits 2-3 Wochen nach der Infektion nachgewiesen werden. Anti-HIV-Antikörper sind ab etwa 4 Wochen nach der Infektion im Serum nachweisbar. In manchen Fällen, wie unter einer PrEP-Anwendung, kann es zu einer stark verzögerten Antikörperbildung kommen.Der sensitivste Marker zum Nachweis einer HIV-Infektion ist die HIV Viruslastbestimmung mittels PCR.Hinweis: Ein positiver Ausfall der Untersuchung muss immer durch einen Bestätigungstest (HIV-PCR oder Western Blot*) überprüft werden. |
| Erregermeldung: | Ein erstmaliger Nachweis von HIV wird nichtnamentlich direkt an das Robert Koch-Institut (RKI) gemeldet. |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag Akutparameter werden am selben Tag übermittelt) |
| Methode: | quantitative Real-time PCR |
| Material: | 3 ml EDTA-Plasma |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren , Plasma abseren und einfrieren |
| Messbereich: | 20 – 10.000.000 Kopien/ml |
| Indikation: | Parameter für die Prognose und die Behandlungsbeurteilung von HIV-infizierten Personen. Kann als Bestätigungstest für eine HIV-Infektion dienen. |
| Referenzbereich: | negativ |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
| Methode: | quantitative Real-time PCR |
| Material: | 3 ml EDTA-Plasma |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren, Plasma abseren und einfrieren |
| Messbereich: | 200 – 1.000.000 Kopien/ml |
| Indikation: | Überwachung der Krankheitsprogression oder Therapieüberwachung bei einer HIV-2 Infektion |
| Durchführung: | bei Bedarf (im externen Partnerlabor) |
| Methode: | Next Generation-Sequencing (NGS) |
| Material: | 3 ml EDTA-Plasma |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren, Plasma abseren und einfrieren |
| Genbereiche: | Je nach Anforderung: Protease und Reverse Transkriptase, Integrase |
| Indikation: | Vor Beginn einer antiretroviralen Therapie sowie bei primären oder sekundärem Therapieversagen vor Umstellung der Therapie.Sie dient zur Ermittlung von HIV-1 – resistenzrelevanten Mutationen, die zu einer Verminderung der Wirksamkeit antiretroviraler Medikamente führen könnten. Die Berücksichtigung individueller Resistenzdaten trägt zum virologischen Therapieerfolg bei und zwar sowohl bei vorbehandelten als auch bei therapienaiven Patienten. |
| Durchführung: | ein bis zweimal wöchentlich (Bearbeitungszeit 5-7 Tag) |
| Hinweis: | Es wird ein ausgefüllter Anforderungsschein benötigt. Siehe Menüpunkt: Formulare |
| Methode: | Next-Generation Sequencing (NGS) |
| Material: | 3 ml EDTA-Plasma. |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren , Plasma abseren und einfrieren |
| Genbereich: | gp120 (V3-loop) |
| Indikation: | Bestimmung des Tropismus (CCR5 oder CXCR4) vor Therapiebeginn mit Maraviroc |
| Durchführung: | Ein- bis zweimal wöchentlich (Bearbeitungszeit 5-7 Tag) |
| Formular: | Es wird ein ausgefüllter Anforderungsschein benötigt. Siehe Menüpunkt: Formulare |
| Methode: | Next-Generation Sequencing (NGS) |
| Material: | 15 - 25 ml EDTA-Vollblut (Kein EDTA-Plasma) |
| Präanalytik: | EDTA-Vollblut: Lagerung bei Raumtemperatur. Nicht zentrifugieren. |
| Genbereiche: | Je nach Anforderung: Protease-, Reverse Transkriptase- Integrase-oder gp120 – Genbereiche |
| Indikation: | Bestimmung der Resistenz oder des Tropismus bei Viruslastwerten von < 100 HIV-1 RNA Kopien/ml |
| Durchführung: | Ein- bis zweimal wöchentlich (Bearbeitungszeit 5-7 Tag) |
| Formular: | Es wird ein ausgefüllter Anforderungsschein benötigt. Siehe Menüpunkt: Formulare |
HEPATITIS A VIRUS:
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Nachweis einer bestehenden oder durchlaufenden HAV Infektion oder zur Verfolgung der Immunreaktion nach einer HAV Impfung. |
| Inkubationszeit: | Das Gesamt anti-HAV (anti-HAV IgM und IgG) ist bereits mit dem Auftreten von Symptomen und aufgrund des Vorhandenseins von IgM positiv. Nach einer natürlichen Infektion sind anti-HAV IgG-Antikörper bereits früh im Infektionsverlauf zu finden. |
| Hinweis: | Bei positivem Ergebnis sollte bei V. a. eine Akutinfektion die Bestimmung des Anti-HAV-IgM erfolgen. |
| Durchführung: | wöchentlich (Bearbeitungszeit 1 Tag) |
HEPATITIS B VIRUS:
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Bei paralleler Untersuchung von HBs-Ag zum Nachweis einer Hepatitis B-Infektion |
| Inkubationszeit: | Anti-HBc tritt frühzeitig nach einer HBV-Infektion auf und ist in der Regel kurz nach dem Auftreten des HBsAg im Serum nachweisbar. |
| Hinweis: | Bei positivem Ergebnis und Verdacht auf eine Akutinfektion sollte die Bestimmung des Anti-HBc-IgM erfolgen. |
| Durchführung: | wöchentlich (Bearbeitungszeit 1 Tag) |
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Immunität nach Impfung oder abgelaufener Hepatitis B |
| Hinweis: | Zusammen mit Anti-HBc ist Anti-HBs ein Nachweis der immunologischen Kontrolle. Ohne vorhandenes Anti-HBc meist Parameter für den Impfschutz. |
| Durchführung: | wöchentlich |
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Suchtest bei Verdacht auf eine akute oder chronische HBV-Infektion |
| Inkubationszeit: | Nachweis etwa 1 bis 5 Monate nach einer möglichen Übertragung. Frühester diagnostischer Marker |
| Hinweis: | Bei einer Persistenz von > 6 Monate liegt eine chronische Infektion vor. Der Verlust von HBs-Antigen spricht in Verbindung mit dem Auftreten von HBs- AK für eine ausgeheilte (immunologisch kontrollierte) Infektion. Zur Beurteilung der Virusaktivität sowie hinsichtlich der Therapieindikation ist die Untersuchung auf HBV-DNA zu empfehlen. 5-10 % der HBV-Infektionen sind HBs-Antigen negativ. |
| Durchführung: | wöchentlich (Bearbeitungszeit 1 Tag) |
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Verlaufskontrolle unter Therapie |
| Erregermeldung: | Dem Gesundheitsamt wird gemäß §7 Abs.1 Nr.20IfSG der direkte oder indirekte Nachweis eines Hepatitis-B-Virus namentlich gemeldet. |
| Inkubationszeit: | Nachweis etwa 1 bis 5 Monate nach einer Übertragung. Frühester diagnostischer Marker |
| Durchführung: | Im Partnerlabor (Bearbeitungszeit ca. 3 Werktage) |
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Bestimmung der Infektiösität bei positivem HBs-Antigen, Progressionsmarker bei chronischer Infektion, Entscheidungshilfe bzgl. einer Therapie |
| Erregermeldung: | Dem Gesundheitsamt wird gemäß §7 Abs.1 Nr.20 IfSG der direkte oder indirekte Nachweis eines Hepatitis-B-Virus namentlich gemeldet. |
| Inkubationszeit: | Nachweis etwa 1 – 5 Monate nach einer Übertragung. Frühester diagnostischer Marker |
| Durchführung: | Im Partnerlabor (Bearbeitungszeit ca. 3 Werktage) |
| Methode: | quantitative Real-time PCR |
| Material: | 3 ml EDTA-Plasma Separate Röhrchen nur für diese Bestimmung |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren , Plasma abseren und einfrieren |
| Referenzbereich: | negativ |
| Messbereich: | 10 – 1.000.000.000 IU/ml |
| Indikation: | Differentialdiagnose akute oder ausgeheilte Hepatitis B; Therapiemarker |
| Erregermeldung: | Gemäß §7 Abs.1 Nr.20 IfSG erfolgt bei einem direkten oder indirekten Nachweis des Hepatitis-B-Virus eine namentliche Meldung beim zuständigen Gesundheitsamt. |
| Durchführung: | 3-mal wöchentlich (Bearbeitungszeit 1 Tag) |
HEPATITIS C VIRUS:
| Methode: | ECLIA (ElectroChemiLumineszenzImmunoAssay) |
| Material: | 1 ml Serum |
| Präanalytik: | Lagerung bei 2-8°C |
| Referenzbereich: | negativ |
| Indikation: | Ausschluss und Diagnose von einer Hepatitis C-Infektion |
| Hinweis: | Ein positiver Befund muss immer durch einen Bestätigungstest (Direktnachweis über HCV-RNA) überprüft werden. Der direkte Erregernachweis erlaubt eine Differenzierung zwischen aktiver und ausgeheilter HCV-Infektion. Bei negativem Virusnachweis sollte gegebenenfalls die Untersuchung im Abstand von 3-6 Monaten wiederholt werden. |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
| Methode: | quantitative Real-time PCR |
| Material: | 3ml EDTA-Plasma |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren , Plasma abseren und einfrieren |
| Referenzbereich: | Negativ |
| Messbereich: | 12 – 100.000.000 IU/ml |
| Indikation: | Differentialdiagnose für eine akute oder ausgeheilte Hepatitis C; Therapiemarker |
| Erregermeldung: | Gemäß §7 Abs.1Nr.20IfSG erfolgt bei einem direkten oder indirekten Nachweis des Hepatitis-C-Virus eine namentliche Meldung beim zuständigen Gesundheitsamt. |
| Inkubationszeit: | HCV-RNA lässt sich in der Regel 4 Wochen nach einem Infektionsrisiko nachweisen. |
| Hinweis: | Behandlungsziel: keine nachweisbare HCV-RNA (Eradikation). Deshalb sollte die HCV RNA Quantifikation vor Therapiebeginn, unter Therapie und bei Therapieende durchgeführt werden. |
| Durchführung: | 3-mal wöchentlich (Bearbeitungszeit 1 Tag) |
| Methode: | Next Generation Sequencing (NGS) |
| Material: | 3ml EDTA-Plasma. |
| Präanalytik: | EDTA-Plasma: EDTA-Vollblut zentrifugieren , Plasma abseren und einfrieren |
| Indikation: | Bestimmung des Genotyps von Hepatitis CVor Beginn einer Hepatitis C-Therapie. Bei Verdacht auf eine Reinfektion. |
| Durchführung: | ein bis zweimal wöchentlich (Bearbeitungszeit 5-7 Tag) |
STI (CT, NG, MG, TV):
| Methode: | Multiplex-PCR (Bestandteil des STI Panels) |
| Material: | oropharyngeale, anale, urethrale Abstriche, Urin |
| Messbereich: | negativ |
| Indikation: | Bei Verdacht auf eine sexuell übertragbare Infektion |
| Hinweis: | Der direkte Nachweis von C. trachomatis-DNA hat die höchste diagnostische Sensitivität und Spezifität. Ein positiver Befund weist auf eine aktive Infektion hin, kann jedoch auch noch einige Zeit nach ausreichend behandelter Erkrankung bestehen. |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
| Methode: | Multiplex-PCR (Bestandteil des STI Panels) |
| Material: | oropharyngeale, anale, urethrale Abstriche, Urin |
| Referenzbereich: | negativ |
| Indikation: | Bei Verdacht auf eine sexuell übertragbare Infektion |
| Hinweis: | Der Nachweis von N. gonorrhoeae mittels PCR sollte mit einem kulturellen Verfahren abgesichert/bestätigt werden. |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
| Methode: | Multiplex-PCR (Bestandteil des STI Panels) |
| Material: | oropharyngeale, anale, urethrale Abstriche, Urin |
| Referenzbereich: | negativ |
| Indikation: | Bei Verdacht auf eine sexuell übertragbare Infektion |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
| Methode: | Multiplex-PCR (Bestandteil des STI Panels) |
| Material: | oropharyngeale, anale, urethrale Abstriche, Urin |
| Referenzbereich: | negativ |
| Indikation: | Bei Verdacht auf eine sexuell übertragbare Infektion |
| Hinweis: | Trichomonaden- Infektionen verlaufen insbesondere beim Mann häufig asymptomatisch. Daher sollte bei nachgewiesener Infektion immer eine Partner-Diagnostik erfolgen. |
| Durchführung: | Jeden Wochentag (Bearbeitungszeit 1 Tag) |
Informationen zu anderen Parametern erhalten Sie auf Anfrage
(info@labor-knechten.de)
Hier erhalten Sie unsere Parameterliste mit unserem Bereich der flexiblen Akkreditierung.
HLAB5701*
HIV-Medikamentenspiegelmessung *
Pharmakogenomik *
* Duchführung im Partnerlabor